
Новосибирские учёные включились в проведение исследований терапии рака генно-модифицированными клетками пациента. Результаты зарубежных коллег обнадёживают: от 50 до 90 процентов больных некоторыми видами рака в терминальной стадии переходят в стойкую ремиссию.
О ситуации с клеточной терапией онкологических заболеваний в России рассказывают старшие научные сотрудники Института молекулярной и клеточной биологии СО РАН, к. б. н. Андрей Горчаков и к. б. н. Сергей Кулемзин:
– Известно, что у нас в организме время от времени появляются раковые клетки. Однако собственная иммунная система обладает способностью такие клетки распознавать и уничтожать. Человек живет и не подозревает о том, от чего защитила его иммунная система.
Но иногда раковые клетки мутируют и «притворяются» здоровыми, тогда иммунная система их не распознаёт. То же может случиться при ослабленном иммунитете. Речь не об ослабленном иммунитете в обиходном понимании, когда мы говорим, что легко подхватываем вирусы или простужаемся, а о том, что отдельные звенья иммунной системы по разным причинам работают неактивно. И тогда раковые клетки начинают бесконтрольно размножаться.
Если мы научимся манипулировать иммунной системой, чтобы она всегда могла опознать раковую клетку, то мощности собственной иммунной системы будет достаточно для излечения от раковых опухолей.
Один из обнадеживающих способов использовать возможности организма в борьбе против онкологических заболеваний, терапия так называемыми Т-лимфоцитами с химерными антигенными (антигены – чуждые для организма вещества, вызывающие его иммунный ответ – ред.) рецепторами, сокращенно CAR-Т, (от англ. сhimeric antigen receptor T-cell) появился сравнительно недавно, в конце ХХ века.
– И его в многочисленных публикациях называют «прорывом в лечении онкологии», «новой эрой в медицине». Почему?
– В чем идея такой молекулы? Одна из её частей распознает маркеры на поверхности опухолевой клетки, а другие части передают в клетку иммунной системы активирующий сигнал на уничтожение клетки опухоли. Производятся CAR-Т клетки следующим образом: из крови пациента извлекаются Т-лимфоциты, то есть клетки, которые в норме должны защищать нас от раковых и заражённых вирусами клеток. Затем в хромосомы Т-лимфоцитов встраивают ДНК, кодирующую CAR, и клетка начинает продуцировать на своей поверхности те самые химерные, то есть, искусственно созданные, не существующие в природе рецепторы. Они сконструированы так, чтобы Т-лимфоциты обнаруживали маркеры на поверхности раковых клеток и получали сигнал атаковать их. Полученные таким образом CAR T-клетки размножают и вводят обратно в кровь пациента.
– Что происходит дальше?
– Если CAR–T в организме пациента сталкиваются с нормальной клеткой, то они просто проплывают мимо друг друга, если обнаруживают раковую клетку, то химерный антигенный рецептор опознаёт на ней специфический маркер, на который он был настроен при создании. Т-лимфоцит убивает раковую клетку и начинает очень активное деление. Из одной клетки, оснащённой CAR–T рецептором, получаются сотни и даже тысячи. Такое саморазмножающееся лекарство.
И пока в каких-то уголках организма будут находиться раковые клетки, CAR–T лимфоциты будут их уничтожать. Когда все раковые клетки будут уничтожены, CAR–T лимфоциты по большей части погибнут, некоторые останутся в костном мозге, чтобы в случае повторных рецидивов снова появиться, размножиться и уничтожить рак.
– Звучит убедительно. Почему же тогда даже в лучшем случае эффективность лечения 50 –90 процентов. А не 100?
– Далеко не всегда опухоль гомогенна по составу. Например, 90 процентов клеток могут нести мишень, на которую нацелены CAR–T лимфоциты, а 10 процентов – нет. И эти 10 процентов остаются в организме нетронутыми и размножаются. Кроме того, даже изначально гомогенная по составу опухоль может «ускользнуть» от CAR–T лимфоцитов, если «уберёт» или модифицирует мишени на поверхности своих клеток. Есть и другие проблемы, осложняющие лечение химерными антигенными рецепторами. Например, несмотря на то, что CAR–T клетки сами по себе могут жить долго, в истощённом множественной химиотерапией организме они будут достаточно вяло размножаться и неэффективно бороться с раковыми клетками. Отчасти поэтому такой подход работает не во всех случаях.
– Известно, какие побочные эффекты возможны при лечении CAR–T клетками?
– В мире уже проведены клинические испытания на нескольких тысячах пациентов с онкогематологическими заболеваниями, такими как острый лимфобластный лейкоз и некоторые варианты лейкемии. Побочные эффекты связаны с тем, что CAR–T клетки оказываются слишком мощными. Атакуя опухолевые клетки, они воздействуют и на другие клетки иммунной системы, заставляя их массово выделять биологически активные вещества, цитокины, и возникает состояние, названное «цитокиновым штормом». Поднимается температура, падает до критических значений давление, возможны галлюцинации, могут отказать почки. Это состояние требует реанимационных мероприятий. Отрадно, что врачи уже научились предсказывать и контролировать развитие цитокинового шторма у большинства пациентов. Кроме того, не будем забывать, что риски, связанные с CAR-T терапией, в общем-то ниже, чем при применяемой у больных лейкозом в качестве последней линии терапии трансплантации костного мозга.
– Для каких видов онкологии CAR–T терапия эффективна уже сегодня?
– Изначально терапию применяли для острого лимфобластного лейкоза, того вида рака, которым чаще всего болеют дети. Возможно, поэтому встречается информация о наибольшей эффективности CAR–T терапии для лечения детей. Но и у взрослых с этим заболеванием результат оказался ничуть не хуже.
Сейчас эта терапия показывает эффективность 50–90 процентов при лечении пациентов даже с терминальной стадией лимфобластного лейкоза, лимфомы и миеломы.
Есть попытки лечить CAR–T клетками так называемые солидные опухоли (солидные опухоли – собирательное обозначение опухолей, которые имеют определённую локализацию – место расположения, и этим отличаются от другой группы – опухолевых заболеваний кроветворной и лимфоидной ткани – лейкозов – ред.), но тут пока не удаётся добиться удовлетворительного результата.
– Почему?
– Дело в том, что CAR–T клетке достаточно тяжело проникать в такую опухоль, надо продвигаться против градиента давления, в солидной опухоли CAR-T клеткам буквально нечем дышать. А раковые клетки к тому же активно защищаются и выделяют вещества, способные убить или «усыпить» CAR–T клетку. Получается, что CAR–T клетки, даже добравшиеся до опухоли, не способны выполнять свои функции. Солидные виды рака встречаются очень часто.
И сейчас сотни компаний по всему миру проводят собственные клинические испытания, чтобы приспособить эту технологию для лечения солидных видов рака. Создаются технологические решения с целью заставить клетку направленно мигрировать в опухоль, выживать в агрессивной среде, привлекать себе в помощь дополнительные клетки иммунной системы. Доклинические исследования на мышах показывают убедительные результаты. Клинические (на пациентах) пока скромные. Но учитывая, что этим сейчас занимается весь мир, очень серьёзные клиники, фармкомпании и университеты, мы уверены в том, что в ближайшее время разные типы онкозаболеваний станут более восприимчивы к CAR–T терапии.
– За счёт чего?
– Можно выбрать другие клетки-носители, – и в этих разработках участвует и наша лаборатория. Или модифицировать саму клетку-носитель, изменить ее геном, чтобы затем изменились ее свойства. Мы подумываем и это делать. Пока мы модифицируем CAR, чтобы они стимулировали лимфоциты не слишком сильно, но и не слишком слабо. Чтобы не стимулировали лимфоцит в отсутствие раковой клетки, чтобы лучше находили редкие маркеры на поверхности раковых клеток. Мы занимаемся созданием и модификацией CAR для маркеров острого лимфобластного лейкоза и рака простаты. В последнем случае мы не можем пока говорить о клиническом результате, работа ведётся на мышах.
– Каковы перспективы применения химерных антигенных рецепторов для лечения онкологических заболеваний в нашей стране?
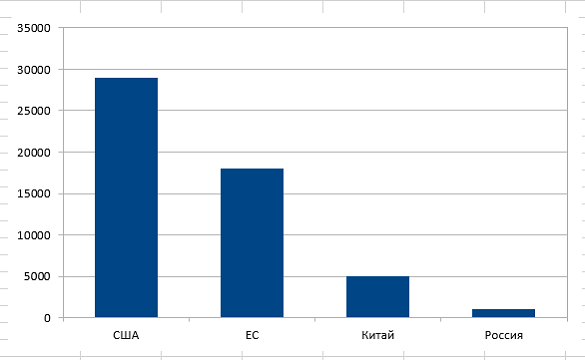
– Обратите внимание на график распределения клинических испытаний по странам мира (график 1). По общему числу проводимых клинических испытаний Китай находится на 3 месте. По CAR–T терапии – на первом! (график 2). И это притом, что фундаментальные научные работы в CAR–T области, в основном, ведутся в США. С чем это связано? За счёт того, что в Китае законодательная политика в отношении проведения клинических испытаний наиболее лояльна, они практически превратили клинические испытания в лечебный процесс. Китайские учёные используют CAR–T, разработанные в лабораториях мира, анализируют чужой опыт, проводят клинические испытания, и одновременно разрабатывают собственные CAR–T продукты. И поток онкологических пациентов из разных стран, в том числе, из России, стремящихся получить CART-клеточную терапию в Китае, становится все больше.
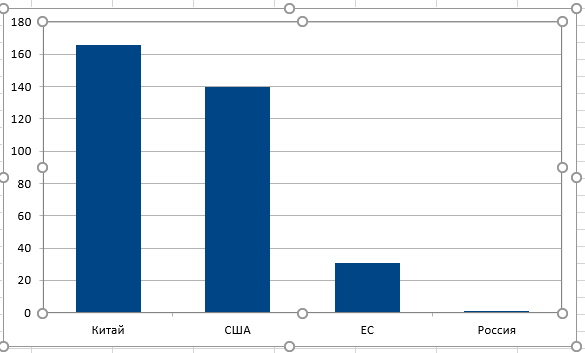
– А что сейчас происходит в этой сфере в России?
– В России, благодаря энергии и энтузиазму врачей, проходит одно клиническое испытание CAR-T клеток в Центре детской онкогематологии им. Димы Рогачёва.
– Против 160 в Китае? Что мешает повторить их опыт?
– Да, китайский путь развития CAR–T терапии выглядит наиболее приемлемым для России. Если же идти по пути создания собственных CAR–T рецепторов с нуля, то нас ждут интересные, но очень долгие исследования, а пациентам можно помочь уже сейчас.
Сложность в том, что существующий Федеральный закон «О биомедицинских клеточных продуктах» от 23.06.2016 N 180-ФЗ (ред. от 03.08.2018) не доработан окончательно. В том варианте, в котором он существует сейчас, внедрение в практику CAR T-клеточных продуктов требует процедур, схожих с внедрением химических препаратов. Даже для доклинических испытаний CAR T-клетки должны быть произведены в формате GMP*, сами испытания должны быть проведены GLP**- cертифицированными лабораториями. Это фактически отрезает академическую науку от разработки CAR T-клеточной терапии. Сейчас учёные надеются на подзаконные акты, которые смягчат существующие требования.
Клеточная терапия – новый инструмент медицины, и к нему должен быть разработан новый, сбалансированный нормативно-правовой подход. А пока к нам приходят письма с вопросами, где и как можно пройти CAR–T терапию. И мы отвечаем: «В Китае».
*надлежащая производственная практика
**надлежащая лабораторная практика

